交流论坛
【分享】巨噬细胞:肿瘤免疫治疗的新热点
免疫疗法被认为是治疗癌症最有前途的疗法。各种肿瘤免疫疗法,包括过继细胞免疫疗法、肿瘤疫苗、抗体、免疫检查点抑制剂和小分子抑制剂,都取得了一定的成功。 巨噬细胞是埃利·梅奇尼科夫(Elie Metchnikoff)最初发现的一种清除外来病原体的吞噬细胞,近年来逐渐被认为是用于肿瘤免疫治疗的细胞。鉴于它们在当前治疗策略中的积极作用,它们已成为改进癌症治疗的潜在靶标。
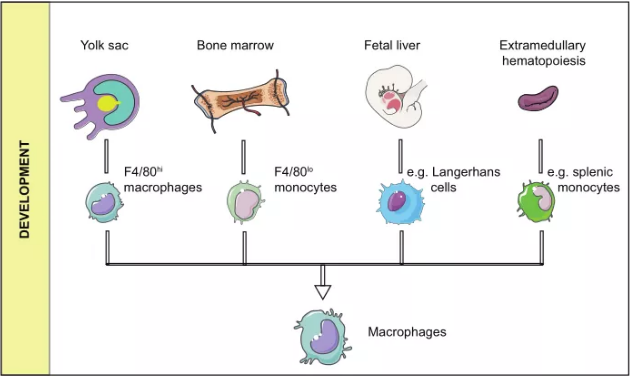
现在人们普遍认为,组织中的巨噬细胞和外周血中的单核细胞都被归类为单核吞噬系统(MPS)。这一概念已经发展了很长一段时间,目前的版本考虑了细胞的起源、形态、功能和动力学。在MPS中,巨噬细胞起源于骨髓干细胞,其发育经历粒-单核祖细胞、前单核细胞和成熟单核细胞三个阶段。单核细胞进入各种组织后,分化为巨噬细胞。单核细胞减少的患者,其巨噬细胞并没有相应减少,这些现象表明巨噬细胞可能来自单核细胞以外的其他来源。根据对小鼠模型的研究,巨噬细胞可能至少有四个来源(图1):(1)来自卵黄囊的F4/80巨噬细胞,主要存在于肝、脾、肺、脑、胰腺和肾等组织;(2)来自骨髓的F4/80巨噬细胞,并在成熟阶段发育为Ly6C+单核细胞;(3)来自胎肝的朗格汉斯细胞;(4)少数研究表明,少数肿瘤相关巨噬细胞可能来自髓外造血,尤其是脾脏。
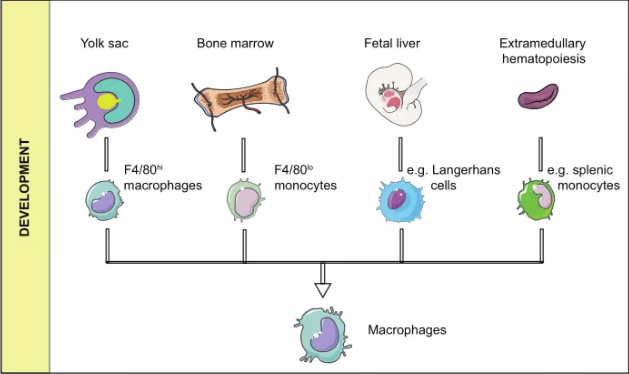
巨噬细胞广泛分布于各种组织中。存在于特定组织中的巨噬细胞按其组织位置可分为肝脏中的Kupffer细胞、脑中的小胶质细胞、骨组织中的破骨细胞、肺中的肺泡巨噬细胞、肾脏中的系膜细胞和淋巴中的被膜下巨噬细胞等。不同组织中的巨噬细胞具有不同的转录和表达谱。
根据表型和功能,巨噬细胞可以地分为M1(促炎,经典激活的巨噬细胞)和M2(抗炎,交替激活的巨噬细胞)类型(图2)。
M2巨噬细胞可被多种细胞因子诱导,如IL-4、IL-13、糖皮质激素、M-CSF/CSF1、IL-10、IL-33、IL-21和TGF-β。伴随着精氨酸酶途径产生的多胺和鸟氨酸的增加,IL-10、PGE2、TGF-β的高分泌和IL-12的低分泌,它们是清除寄生虫和动态平衡的主要参与者,如组织重塑和再生、伤口愈合和抗炎。当M2巨噬细胞进一步发育时,它们被细化为M2a、M2b、M2c和M2d亚群。
肿瘤相关巨噬细胞(TAMs)通常是肿瘤中髓系细胞的主要组成部分。对于某些实体肿瘤,TAMs可以来自几个来源:来自卵黄囊的残余巨噬细胞,作为主要补充的浸润巨噬细胞从骨髓/Ly6C+循环单核细胞招募,以及少数来自脾脏。 在大多数已建立的肿瘤中,TAMs倾向于被认为是M2型的巨噬细胞,因为它们具有M2巨噬细胞的大多数代表性特性,转录组分析表明,TAMs更类似于胎儿巨噬细胞,而不是炎性巨噬细胞。然而,然而,由于巨噬细胞是可塑性的,也有证据表明TAMs实际上既有M1和M2的表达模式,也有与M1和M2巨噬细胞不同的表达模式。已有研究表明,M1巨噬细胞可能通过创造诱变的微环境来诱导肿瘤的发生,而M2巨噬细胞则促进肿瘤的进展,并认为TAMs可能兼具促肿瘤和抑瘤作用,这使得TAMs成为肿瘤治疗的潜在靶点。
小鼠巨噬细胞主要表达CD11b、F4/80和CSF1R,在人类中则表达CD79、CD163、CD16、CD312和CD115 等经典markers。M1巨噬细胞为了呈递抗原和激活适应性免疫反应,经常表达高水平的MHCⅡ类分子和共刺激分子,如CD40、CD80和CD86,而M2巨噬细胞则含有上调的终末分子。极化的巨噬细胞产生不同类型的趋化因子。CXCL9、CXCL10、CXCL11和CCL5通常由M1巨噬细胞分泌以招募Th1、Th17和细胞毒性T细胞,而CCL2、CCL17、CCL18、CCL22和CCL24通常是由M2巨噬细胞分泌的。
巨噬细胞通过分泌各种因子和影响其他免疫细胞,不仅在慢性炎症中发挥作用,而且还能启动、促进或抑制癌症的发展。鸟氨酸、血管内皮生长因子、表皮生长因子和TGF-β是来自巨噬细胞的促肿瘤因子,而巨噬细胞中诱导一氧化氮合酶产生的一氧化氮可以抑制肿瘤生长。巨噬细胞已被证明直接或间接地参与恶性肿瘤的几个关键特征,包括血管生成、侵袭、转移、肿瘤微环境的调节和治疗耐药性(图3)。
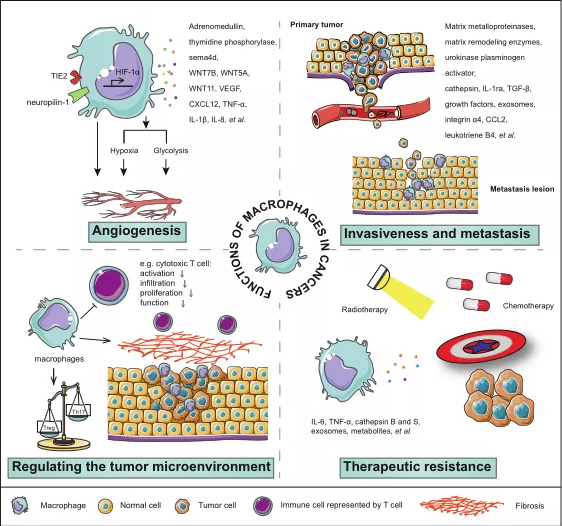
在肿瘤免疫治疗中,靶向巨噬细胞有几个优点。低浸润是以T细胞为基础的抗癌治疗的主要障碍,而在肿瘤微环境中,巨噬细胞占据了浸润免疫细胞的30-50%。循环中的单核细胞是肿瘤中浸润巨噬细胞的主要来源,而外周血单核细胞的可获得性使临床上采用以巨噬细胞为基础的治疗策略变得更容易操作。
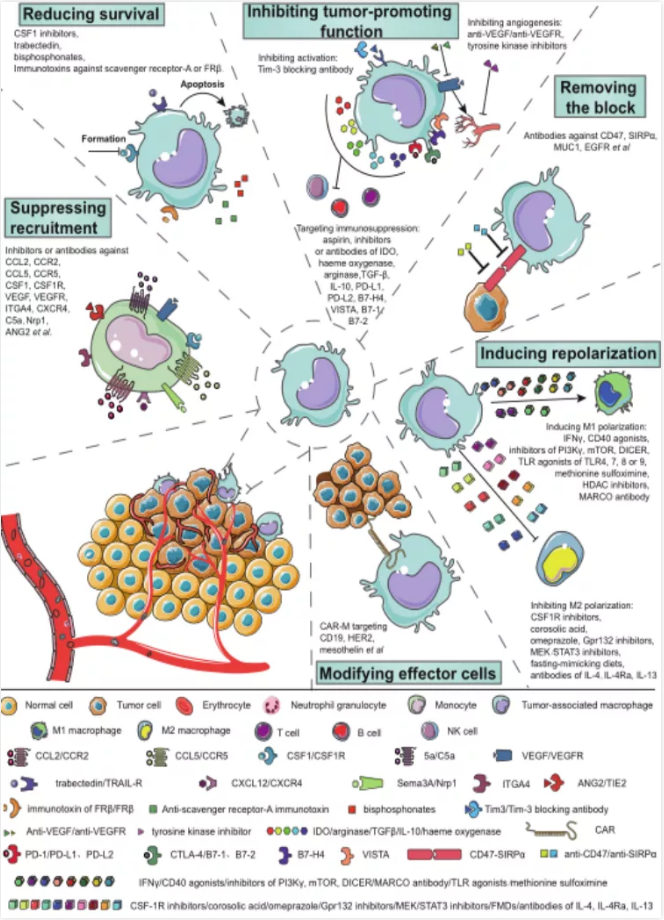
目前针对巨噬细胞的策略根据它们的靶标被分为六类(图4)。
抑制巨噬细胞募集;单核/巨噬细胞表面的CCR2、CCR5、VEGFR、CSF1R、ITGA4和C5a等分子有助于巨噬细胞向肿瘤的浸润。针对它们或它们的某些配体(如CCL2、CCL5、VEGF和CSF1) 的抑制剂或抗体可以抑制巨噬细胞的募集。靶向Nrp1和ANG2导致的血管生成减少也可能导致巨噬细胞募集的减少。
巨噬细胞存活率下降:由于CSF1是巨噬细胞分化的关键信号,CSF1抑制剂可抑制巨噬细胞的形成。曲贝替丁还可以通过诱导凋亡来降低巨噬细胞的存活率。针对清道夫受体A或叶酸受体β的免疫毒素可以耗尽TAMs。
抑制促肿瘤功能;据报道,TIM-3封闭抗体可调节TAMs的激活。通过抑制血管生成,抗VEGF、抗VEGFR和酪氨酸激酶抑制剂可以削弱TAMs的前列腺癌功能。TAMs通过表达IDO、血红素加氧酶、精氨酸酶、TGF-β、IL-10、前列腺素等参与免疫抑制微环境的形成。阿司匹林可以减少前列腺素的生成。阻断巨噬细胞上的免疫检查点(PD-L1、PD-L2、B7-H4、Vista、B7-1和B7-2)可以解除其他免疫细胞的功能。
解除巨噬细胞上的blockade。肿瘤细胞表面的CD47与巨噬细胞表面的Sirpα相互作用,帮助肿瘤细胞逃避巨噬细胞的吞噬。抗CD47或Sirpα抗体可解除这一阻断。
表型极化的诱导:越来越多的人认识到,巨噬细胞重新编程,而不是一刀切地耗尽,可能是在癌症治疗中利用TAMs的更好方法。事实上,一些临床前研究表明,TAMS可以被重新编程以获得免疫刺激能力,例如,增强ICB和其他免疫疗法的疗效。TAMs的M1极化与抗肿瘤反应有关,M2极化与促肿瘤活性有关。几种因素可以诱导M1极化,包括干扰素γ、CD40激动剂、PI3Kγ/mTOR/DICER抑制剂、TLR4/7/8/9激动剂、蛋氨酸亚砜、组蛋白去乙酰化酶(Hdac)抑制剂以及巨噬细胞胶原结构受体抗体(Marcos)。相反,抑制M2极化的因素,如CSF1R抑制剂、GPR132抑制剂、MEK/STAT3抑制剂、以及IL-4、IL-4Rα和IL-13抗体,也可以减轻肿瘤负担。
效应细胞的修饰:类似CART细胞的嵌合抗原受体巨噬细胞(CAR-Ms)已被用于增强杀瘤功能。CAR-Ms具有克服细胞疗法在实体肿瘤环境中遇到的一些关键挑战的潜力,并代表了一种可广泛应用于各种肿瘤抗原靶点的新型免疫治疗平台。工程化的单核细胞来源的巨噬细胞结合了髓系细胞的肿瘤转移能力、永久的促炎M1表型、CAR介导的靶向抗肿瘤活性和专业的抗原提呈,从而建立了多模式的抗肿瘤反应,目前已经探索了基于CD19、HER2和间皮素等靶点的CAR-Ms。今年的2月份,Carisma Therapeutics公司完成基于HER2 靶点的CAR-M疗法首例给药,这标志CAR-M疗法正式进入临床阶段。
巨噬细胞在肿瘤微环境中是一把双刃剑。一方面巨噬细胞作为肿瘤基质细胞的重要组成部分,可以聚集在血管周围,诱导血管生成,促进肿瘤侵袭。另一方面,它们还可以吞噬癌细胞,重塑肿瘤微环境。
巨噬细胞为肿瘤免疫治疗提供了更多的选择以及不可低估的力量。关于巨噬细胞更多的的研究将会为肿瘤治疗打开一扇新的大门。为了应对各种恶性肿瘤,未来需要探索更多与巨噬细胞联合的治疗策略。
转自生物制药小编

